*The table is not exhaustive.
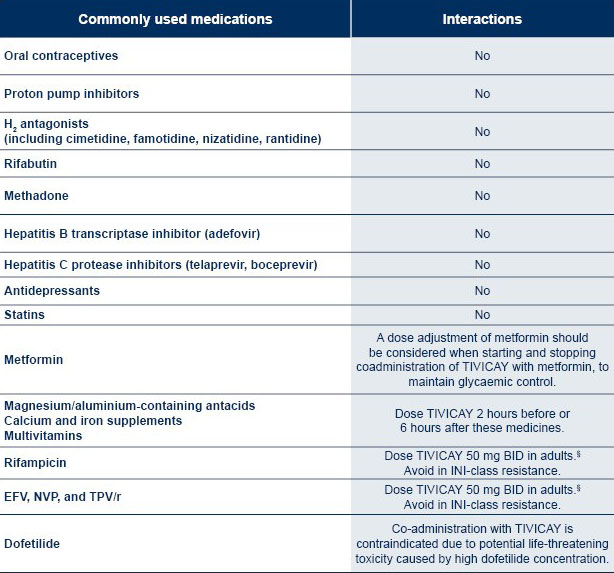
§In paediatric patients the weight-based once daily dose should be administered twice daily if used in combination with these medications.1
EFV: efavirenz
NVP: nevirapine
TPV/r: tipranavir/ritonavir
For a more comprehensive list of interactions, please see the HIV DDI database of University of Liverpool.
Contraindications
TIVICAY and dofetilide coadministration is contraindicated due to potential life-threatening toxicity caused by high dofetilide concentration.1
For further information on Tivicay safety, please see the Summary of Product Characteristics.
References:
- TIVICAY Summary of Product Characteristics
- Fantauzzi A, Turriziani O, Mezzaroma I. Potential benefit of dolutegravir once daily: efficacy and safety. HIV/AIDS (Auckl). 2013;5:29-40. doi: 10.2147/HIV.S27765
- Teixeira R, Nascimento Y, Crespo D. Safety aspects of protease inhibitors for chronic hepatitis C: adverse events and drug-to-drug interactions. Braz J Infect Dis. 2013;17(2):194-204.
- Patel P, Song I, Borland J, et al. Pharmacokinetics of the HIV integrase inhibitor S/GSK1349572 co-administered with acid- reducing agents and multivitamins in healthy volunteers. J Antimicrob Chemother. 2011;66(7):1567-1572.
- Kandel CE, Walmsley S. Dolutegravir - a review of the pharmacology, efficacy, and safety in the treatment of HIV. Drug Design, Development and Therapy. 2015:9 3547-3555. doi: 10.2147/DDDT.S84850
TIVICAY is a registered trademark of the ViiV Healthcare group of companies.
TIVICAY (dolutegravir) Rx, EF, ATC kod J05AX12
Filmdragerade tabletter innehållande dolutegravir , 10, 25, 50 mg samt 5mg dispergerbara tabletter.
Indikation: TIVICAY är indicerat i kombination med andra antiretrovirala läkemedel för behandling av humant immunbristvirus (hiv) hos vuxna, ungdomar och barn från från 4 veckors ålder och som väger minst 3 kg.
Kontraindikationer: Överkänslighet mot dolutegravir eller mot något hjälpämne. Samtidig administrering med läkemedel som har ett smalt terapeutiskt fönster och som är substrat för organisk katjontransportör 2 (OCT2), tex fampridin.
Varningar och försiktighet: Behandling ska förskrivas av läkare med erfarenhet av behandling av hiv-infektion. Dolutegravir är förenat med en risk för överkänslighetsreaktion och bör omedelbart sättas ut vid tecken eller symtom på detta. Nedsatt njurfunktion: Ingen dosjustering krävs. Nedsatt leverfunktion: Ingen dosjustering krävs för patienter med lätt eller måttlig leverfunktionsnedsättning. Inga data finns för patienter med svår leverfunktionsnedsättning. Kombinationen dolutegravir (50 mg) och lamivudin (300mg) som fullständig behandling är endast lämplig för behandling av hiv-1 infektion där det inte finns eller misstänks finnas resistens mot integrashämmarklassen eller lamivudin. Det finns inga data tillgängliga på dolutegravir och lamivudin som en två-komponentsbehandling för de pediatriska patienterna.
Interaktioner: TIVICAY ska administreras två gånger dagligen vid samtidig administrering med etravirin, efavirenz, nevirapin, tipranavir/ritonavir, karbamazepin, oxkarbazepin, fenytoin, fenobarbital, rifampicin eller johannesört. Antacida som innehåller flervärda katjoner, kalciumtillskott, järntillskott eller multivitaminer ska intas separerat i tid från administrering av dolutegravir (minst 2 timmar efter eller 6 timmar före). Dolutegravir ökar koncentrationen av metformin. Dosjustering av metformin ska övervägas vid insättning och utsättning av samtidig administrering av dolutegravir och metformin, för att bevara glykemisk kontroll. Metformin elimineras renalt och det är därför viktigt att kontrollera njurfunktionen vid samtidig administrering av dolutegravir. Denna kombination kan öka risken för laktacidos hos patienter med måttligt nedsatt njurfunktion.
Graviditet och Amning: Fertila kvinnor ska få rådgivning avseende den potentiella risken för neuralrörsdefekter med dolutegravir, och effektiva preventivmedel ska övervägas. Om en kvinna planerar att bli gravid ska nyttan och riskerna med att fortsätta behandlingen med dolutegravir diskuteras med patienten. Om graviditet konstateras under första trimestern medan behandling med dolutegravir pågår ska nyttan och riskerna med fortsatt behandling med dolutegravir kontra byte till en annan antiretroviral regim diskuteras med patienten. Hänsyn ska tas till gestationsåldern och den kritiska tidsperioden med avseende på utveckling av neuralrörsdefekter. Dolutegravir kan användas under graviditetens andra och tredje trimester när den förväntade nyttan överväger den eventuella risken för fostret. Dolutegravir utsöndras i små mängder i bröstmjölk. Det finns otillräcklig information om dolutegravirs effekter på nyfödda/spädbarn.
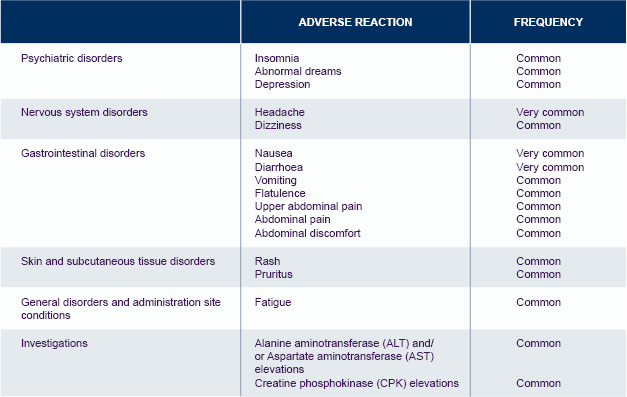
Biverkningar: De vanligaste rapporterade biverkningarna som ansågs möjligen eller troligen relaterade till dolutegravir var diarré (18%), illamående (13%) och huvudvärk (13%). En allvarlig biverkning som har rapporterats med dolutegravir är överkänslighetsreaktion med hudutslag och allvarlig leverpåverkan. Hos patienter med depression eller psykisk sjukdom i anamnesen har självmordstankar och självmordsförsök förekommit.
För fullständig förskrivarinformation, se www.fass.se. Datum för översyn av produktresumén 2022-02-10. GSK, Box 516, 169 29 Solna. Tel: 08-638 93 00, se.gsk.com






