How to prescribe Tivicay?
Convenience beyond once-daily dosing
TIVICAY (dolutegravir) is a once-daily, unboosted integrase inhibitor indicated in combination with other anti-retroviral medicinal products for the treatment of Human Immunodeficiency Virus (HIV) infected adults, adolescents and children above 6 years of age. 1
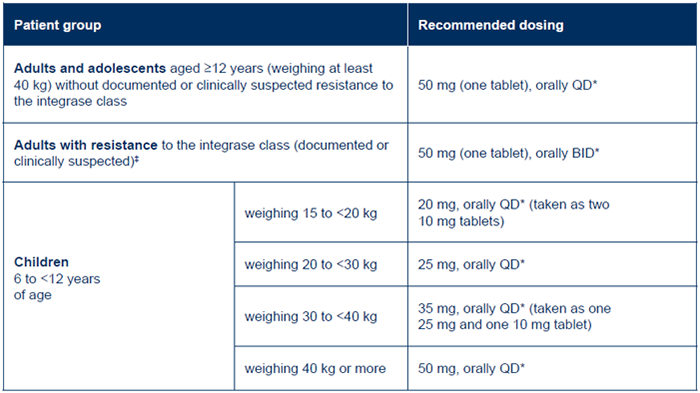
Dosing recommendations 1
Available tablet strengths 1
- 10 mg film-coated tablets: white, round, biconvex tablets approximately 6 mm in diameter
- 25 mg film-coated tablets: pale yellow, round, biconvex tablets approximately 7 mm in diameter
- 50 mg film-coated tablets: yellow, round, biconvex tablets approximately 9 mm in diameter
Contraindications 1
Hypersensitivity to the active substance or to any of the excipients. Co-administration with dofetilide.
For further information, please see Tivicay prescribing information
*Must be taken in combination with other antiretroviral agents. 1
**In the presence of INI class resistance, TIVICAY should preferably be taken with food to enhance exposure (particularly in patients with Q148 mutations). 1
‡In the presence of integrase inhibitor resistance, there are insufficient data to recommend a dose for dolutegravir in adolescents and children. 1
TIVICAY is a registered trademark of the ViiV Healthcare group of companies.
TIVICAY (dolutegravir) Rx, EF, ATC kod J05AX12
Filmdragerade tabletter innehållande 10, 25 eller 50 mg dolutegravir (som natrium).
Indikation: TIVICAY är indicerat i kombination med andra antiretrovirala läkemedel för behandling av humant immunbristvirus (hiv) hos vuxna, ungdomar och barn över 6 år.
Kontraindikationer: Överkänslighet mot dolutegravir eller mot något hjälpämne. Samtidig administrering av dofetilid.
Varningar och försiktighet: Behandling ska förskrivas av läkare med erfarenhet av behandling av hiv-infektion. Dolutegravir är förenat med en risk för överkänslighetsreaktion och bör omedelbart sättas ut vid tecken eller symtom på överkänslighetsreaktion. Nedsatt njurfunktion: Ingen dosjustering krävs. Nedsatt leverfunktion: Ingen dosjustering krävs för patienter med lätt eller måttlig leverfunktionsnedsättning. Inga data finns för patienter med svår leverfunktionsnedsättning.
Kombinationen dolutegravir (50 mg) och lamivudin (300mg) som fullständig behandling är endast lämplig för behandling av hiv-1 infektion där det inte finns eller misstänks finnas resistens mot integrashämmarklassen eller lamivudin. Det finns inga data tillgängliga på dolutegravir och lamivudin som en två-komponentsbehandling för de pediatriska patienterna.
På grund av den potentiella risken för neuralrörsdefekter ska dolutegravir inte användas under den första trimestern, utom i de fall där det saknas alternativ. Dolutegravir skall ej förskrivas till kvinnor som önskar bli gravida. Kvinnor i fertil ålder bör använda ett effektivt preventivmedel under tiden som dolutegravir används.
Interaktioner: TIVICAY ska administreras två gånger dagligen vid samtidig administrering med efavirenz, nevirapin, tipranavir/ritonavir eller rifampicin. Till patienter med resistens mot integrashämmare ska TIVICAY tas två gånger dagligen och helst tillsammans med mat för att öka exponeringen samtidigt som faktorer som minskar exponeringen för dolutegravir ska undvikas. Detta inkluderar samtidig administrering med magnesium- och aluminiuminnehållande antacida, järn- och kalciumtillskott och multivitaminer. Dolutegravir ökar koncentrationen av metformin. Dosjustering av metformin ska övervägas vid insättning och utsättning av samtidig administrering av dolutegravir och metformin, för att bevara glykemisk kontroll. Metformin elimineras renalt och det är därför viktigt att kontrollera njurfunktionen vid samtidig administrering av dolutegravir. Denna kombination kan öka risken för laktacidos hos patienter med måttligt nedsatt njurfunktion.
Biverkningar: Den allvarligaste biverkningen som sågs hos en enskild patient var överkänslighetsreaktion med utslag och allvarlig leverpåverkan. De vanligaste rapporterade biverkningarna som ansågs möjligen eller troligen relaterade till dolutegravir var diarré (18%), illamående (13%) och huvudvärk (13%).
För fullständig förskrivarinformation, se www.fass.se. Datum för översyn av produktresumén 2019-04-18







