Latest questions
ViiV responds to questions from the healthcare professional community.
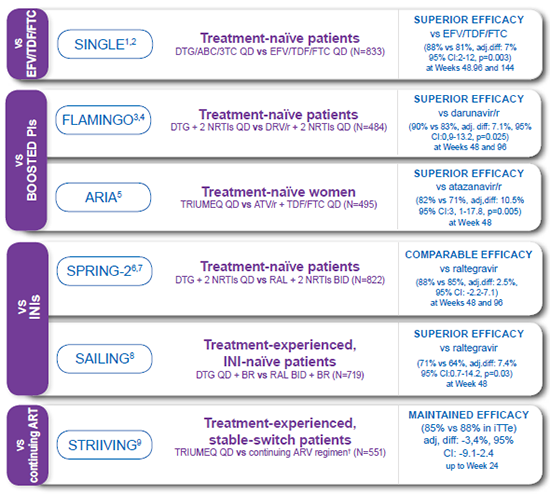
Q2. How does the efficacy of dolutegravir compare to Atripla® in treatment-naïve patients?
In the SINGLE study, n=833, DTG + ABC/3TC was statistically superior to Atripla® with respect to the proportion of patients achieving HIV-1 RNA <50 c/mL (FDA snapshot) at Week 48 (88% vs 81%, respectively; p=0.003).1 71% in the dolutegravir + abacavir/lamivudine arm and 63% in the efavirenz/tenofovir/emtricitabine arm maintained viral loads of < 50 copies/mL through week 144.2
Q3. How does the efficacy of dolutegravir compare with other integrase inhibitors?
SPRING-2 was the first head-to-head, double-blind comparison of efficacy and safety of two INI-based regimens for first-line ART. Once daily dolutegravir was non-inferior to twice daily raltegravir, when co-administered with 2 NRTIs at 48 weeks, in treatment-naive patients. 7
In addition, in the SAILING study, in treatment-experienced, integrase-inhibitor-naive patients, virologic suppression (HIV-1 RNA<50 copies/mL) in the dolutegravir arm (71%) was statistically superior to the raltegravir arm (64%), at week 48 (p=0.03). 8
Q4. Is dolutegravir equally effective when given with either Truvada or Kivexa?
Yes, in the SPRING-2 7 and FLAMINGO 3 studies, DTG demonstrated comparable or similar efficacy regardless of backbone regimen.
Q5. What are the most common adverse events that have been reported with dolutegravir?
The most commonly seen treatment emergent adverse reactions were nausea (13%), diarrhoea (18%), and headache (13%). 10
Q6. How does the tolerability profile of dolutegravir compare to other antiretroviral agents?
In the SINGLE study, dolutegravir + ABC/3TC was generally better tolerated vs. Atripla® with fewer discontinuations. 1 In both SPRING-2 (treatment naive) and SAILING (treatment experienced) studies, dolutegravir had a similar tolerability profile to raltegravir. 7 8
References:
- Walmsley S, Antela A, Clumeck N, et al, for the SINGLE Investigators. Dolutegravir plus abacavir-lamivudine for the treatment of HIV-1 infection. N Engl J Med. 2013;369(19):1807-1818.
- Walmsley S, Baumgarten A, Berenguer J et al; Dolutegravir Plus Abacavir/Lamivudine for the Treatment of HIV-1 Infection in Antiretroviral Therapy-Naive Patients: Week 96 and Week 144 Results from the SINGLE Randomized CLinical Trial; J Acquir immune Defic Syndrome, 2015 Dec 15; 70(5); 515-9.
- Clotet B, Feinberg J, van Lunzen J, et al, on behalf of the ING114915 Study Team. Once-daily dolutegravir versus darunavir plus ritonavir in antiretroviral-naive adults with HIV-1 infection (FLAMINGO): 48 week results from the randomised open-label phase 3b study. Lancet. 2014;383(9936):2222-2231.
- Molina JM, Clotet B, van Lunzen J, et al; on behalf of the FLAMINGO Study Team. Once-daily dolutegravir versus darunavir plus ritonavir for treatment-naive adults with HIV-1 infection (FLAMINGO): 96 week results from a randomised, open-label, phase 3b study. Lancet HIV. 2015 Apr;2(4):e127-36.
- Orrell C, Hagins DP, Belonosova E, et al, for the ARIA study team. Fixed dose combination dolutegravir, abacavir, and lamivudine versus ritonavir-boosted atazanavir plus tenofovir disoproxil fumarate and emtricitabine in previously untreated women with HIV-1 infection (ARIA): week 48 results from a randomised, open-label, non-inferiority, phase 3b study. Lancet HIV 2017; published online July 17. http://dx.doi.org/10.1016/S2352-3018(17)30095-4.
- Raffi F, Rachlis A, Stellbrink HJ, et al; on behalf of the SPRING-2 Study Group. Once-daily dolutegravir versus raltegravir in antiretroviral-naive adults with HIV-1 infection: 48 week results from the randomised, double-blind, non-inferiority SPRING-2 study. Lancet. 2013 Mar 2;381(9868):735-43.
- Raffi F, Jaeger H, Quiros-Roldan E, et al, on behalf of the extended SPRING-2 Study Group. Once-daily dolutegravir versus twice-daily raltegravir in antiretroviral-naïve adults with HIV-1 infection (SPRING-2 study): 96 week results from a randomised, double-blind, non-inferiority trial. Lancet Infect Dis. 2013;13(11):927-935.
- Cahn P, Pozniak AL, Mingrone H, et al, on behalf of the extended SAILING Study Team. Dolutegravir versus raltegravir in antiretroviral-experienced, integrase-inhibitor-naive adults with HIV: week 48 results from the randomised, double-blind, non-inferiority SAILING study. Lancet. 2013;382(9893):700-708.
- Trottier B, Lake JE, Logue K, et al. Dolutegravir/abacavir/lamivudine versus current ART in virally suppressed patients (STRIIVING): a 48-week, randomized, non-inferiority, open-label, Phase IIIb study. Antivir Ther. 2017 Apr 12. doi: 10.3851/IMP3166.
- TIVICAY (dolutegravir) Summary of Product Characteristics.
TIVICAY is a registered trademark of the ViiV Healthcare group of companies.
TIVICAY (dolutegravir) Rx, EF, ATC kod J05AX12
Filmdragerade tabletter innehållande dolutegravir , 10, 25, 50 mg samt 5mg dispergerbara tabletter.
Indikation: TIVICAY är indicerat i kombination med andra antiretrovirala läkemedel för behandling av humant immunbristvirus (hiv) hos vuxna, ungdomar och barn från från 4 veckors ålder och som väger minst 3 kg.
Kontraindikationer: Överkänslighet mot dolutegravir eller mot något hjälpämne. Samtidig administrering med läkemedel som har ett smalt terapeutiskt fönster och som är substrat för organisk katjontransportör 2 (OCT2), tex fampridin.
Varningar och försiktighet: Behandling ska förskrivas av läkare med erfarenhet av behandling av hiv-infektion. Dolutegravir är förenat med en risk för överkänslighetsreaktion och bör omedelbart sättas ut vid tecken eller symtom på detta. Nedsatt njurfunktion: Ingen dosjustering krävs. Nedsatt leverfunktion: Ingen dosjustering krävs för patienter med lätt eller måttlig leverfunktionsnedsättning. Inga data finns för patienter med svår leverfunktionsnedsättning. Kombinationen dolutegravir (50 mg) och lamivudin (300mg) som fullständig behandling är endast lämplig för behandling av hiv-1 infektion där det inte finns eller misstänks finnas resistens mot integrashämmarklassen eller lamivudin. Det finns inga data tillgängliga på dolutegravir och lamivudin som en två-komponentsbehandling för de pediatriska patienterna.
Interaktioner: TIVICAY ska administreras två gånger dagligen vid samtidig administrering med etravirin, efavirenz, nevirapin, tipranavir/ritonavir, karbamazepin, oxkarbazepin, fenytoin, fenobarbital, rifampicin eller johannesört. Antacida som innehåller flervärda katjoner, kalciumtillskott, järntillskott eller multivitaminer ska intas separerat i tid från administrering av dolutegravir (minst 2 timmar efter eller 6 timmar före). Dolutegravir ökar koncentrationen av metformin. Dosjustering av metformin ska övervägas vid insättning och utsättning av samtidig administrering av dolutegravir och metformin, för att bevara glykemisk kontroll. Metformin elimineras renalt och det är därför viktigt att kontrollera njurfunktionen vid samtidig administrering av dolutegravir. Denna kombination kan öka risken för laktacidos hos patienter med måttligt nedsatt njurfunktion.
Graviditet och Amning: Fertila kvinnor ska få rådgivning avseende den potentiella risken för neuralrörsdefekter med dolutegravir, och effektiva preventivmedel ska övervägas. Om en kvinna planerar att bli gravid ska nyttan och riskerna med att fortsätta behandlingen med dolutegravir diskuteras med patienten. Om graviditet konstateras under första trimestern medan behandling med dolutegravir pågår ska nyttan och riskerna med fortsatt behandling med dolutegravir kontra byte till en annan antiretroviral regim diskuteras med patienten. Hänsyn ska tas till gestationsåldern och den kritiska tidsperioden med avseende på utveckling av neuralrörsdefekter. Dolutegravir kan användas under graviditetens andra och tredje trimester när den förväntade nyttan överväger den eventuella risken för fostret. Dolutegravir utsöndras i små mängder i bröstmjölk. Det finns otillräcklig information om dolutegravirs effekter på nyfödda/spädbarn.
Biverkningar: De vanligaste rapporterade biverkningarna som ansågs möjligen eller troligen relaterade till dolutegravir var diarré (18%), illamående (13%) och huvudvärk (13%). En allvarlig biverkning som har rapporterats med dolutegravir är överkänslighetsreaktion med hudutslag och allvarlig leverpåverkan. Hos patienter med depression eller psykisk sjukdom i anamnesen har självmordstankar och självmordsförsök förekommit.
För fullständig förskrivarinformation, se www.fass.se. Datum för översyn av produktresumén 2022-02-10. GSK, Box 516, 169 29 Solna. Tel: 08-638 93 00, se.gsk.com






