Nucala clinical trial data
Learn about the Phase III clinical trial data for Nucala – the first targeted anti-IL-5 add-on therapy for adult patients with severe refractory eosinophilic asthma.
In the MENSA study, Nucala reduced the rate of clinically significant exacerbations by 53% vs. placebo (primary endpoint), when both were added to high dose ICS and an additional maintenance treatment(s). Improved measures of quality of life and lung function (secondary endpoints) were also observed however statistical significance cannot be inferred due to the hierarchical ‘gate-keeping’ approach used.
In the SIRIUS study, Nucala reduced patients’ daily OCS dose, while maintaining asthma control vs. placebo (primary endpoint).
Exacerbation data
Nucala significantly reduced exacerbations by 53% (MENSA primary endpoint)
Nucala reduced clinically significant exacerbations vs. placebo when both were added to high dose ICS and an additional maintenance treatment(s). 1
Reduction in exacerbation frequency vs. placebo at Week 32 (primary endpoint) 1
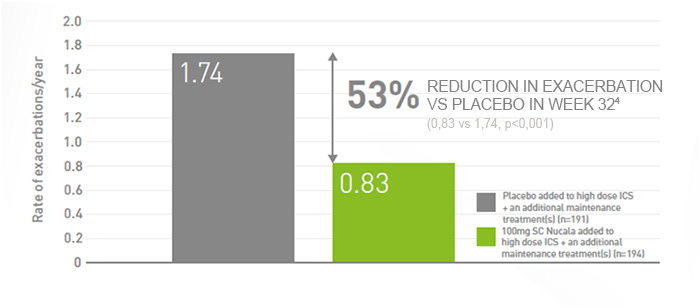
- At the start of the study, the baseline rate of exacerbations was similar for both treatment arms (placebo: 3.6/year; Nucala: 3.8/year) 1
- Clinically significant exacerbations of asthma were defined as the worsening of asthma that required use of systemic corticosteroids for at least three days or required hospitalisation and/or emergency department (ED) visits 1
For more information on the MENSA study design
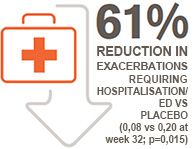
Nucala also significantly reduced exacerbations resulting in hospitalisation and/or emergency department (ED) visits (MENSA secondary endpoint)
Nucala also significantly reduced exacerbations resulting in hospitalisations and/or ED visits vs. placebo when both were added to high dose ICS and an additional maintenance treatment(s) by 61% (Nucala: 0.08/year, placebo: 0.2/year; p=0.02).* 1
Nucala reduced blood eosinophils by 84% without complete deletion (290 cells/microl at baseline vs 40 cells/microl at week 32, (N=182))
Nucala added to high dose ICS and an additional maintenance treatment(s) reduced blood eosinophil levels by 84% compared with placebo added to high dose ICS and an additional maintenance treatment(s) at Week 32. 2
Nucala treatment led to a reduction in geometric mean count from 290 cells/μL at baseline to 40 cells/μL at Week 32. 2
For more information on the MENSA study design
To download a copy of the MENSA study summary
Quality of life data
Nucala improved health-related quality of life (MENSA secondary endpoint)
Nucala improved health-related quality of life (measured using SGRQ) vs. placebo when both were added to high dose ICS and an additional maintenance treatment(s) by 7.0 units. 1
Improvement in SGRQ total score from baseline at Week 32 (MENSA secondary endpoint) 1
Statistical significance cannot be inferred due to the hierarchical ‘gatekeeping’ approach used. The p-values provided are unadjusted for multiple comparisons.
- At the start of the study, baseline SGRQ total scores were similar for both treatment arms (placebo: 46.9 units; Nucala: 47.9 units). 1
- The St. George’s Respiratory Questionnaire (SGRQ) is a validated disease-specific health status assessment for use in asthma and COPD and a difference of ≥4 units is considered clinically meaningful. 3
For further information on the MENSA study design.
Lung function data
Nucala improved lung function (MENSA secondary endpoint)
Nucala improved lung function (as measured by pre-bronchodilator FEV1) vs. placebo when both were added to high dose ICS and an additional maintenance treatment(s) by 98mL. 1
Improvement in lung function from baseline at Week 32 (MENSA secondary endpoint) 1
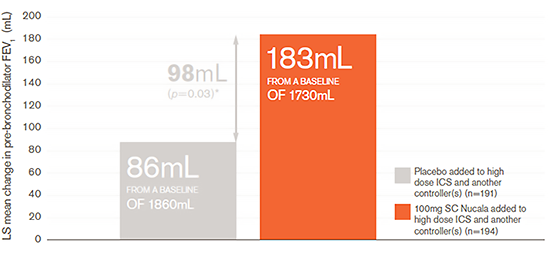
Statistical significance cannot be inferred due to the hierarchical ‘gatekeeping’ approach used. The p-values provided are unadjusted for multiple comparisons.
- At the start of the study, baseline values were similar for both treatment arms (placebo: 1860mL, Nucala: 1730mL). 1
For further information on the MENSA study design
Oral corticosteroid sparing data
Nucala reduced patients’ daily OCS dose, while maintaining symptom control (SIRIUS primary endpoint)
The odds of achieving a reduction in OCS dose while maintaining symptom control were 2.39 times higher in patients receiving Nucala (n=69) vs. placebo* (n=66; p=0.008) 4
- 54% (37/69) of Nucala patients achieved at least a 50% reduction in the daily OCS dose compared with 33% (22/66) of patients receiving placebo* (secondary endpoint, p=0.03) 4
- 54% (37/69) of Nucala patients achieved a reduction in the daily OCS dose to ≤5mg compared with 32% (21/66) of subjects receiving placebo* (secondary endpoint, p=0.02) 4
- The median percentage reduction in daily OCS dose was 50% in the Nucala group, compared with 0% in the placebo group* (secondary endpoint, p=0.007) 4
- In the Nucala group, 14% (10/69) of patients achieved a total cessation of OCS dose compared with 8% (5/66) in the placebo group* (secondary endpoint, p=ns) 4
*when both were added to high dose ICS and an additional maintenance treatment(s)
- At the start of the study the baseline median daily OCS dose (optimised dose) was similar between treatment groups (placebo: 12.5mg; Nucala: 10.0mg). 4
For further information on the SIRIUS study design

Safety data from the Nucala clinical trial programme
Safety profile of Nucala
A total of 915 patients with severe refractory eosinophilic asthma have received either a subcutaneous (SC) or intravenous (IV) dose of Nucala during clinical studies of 24 to 52 weeks duration. Nucala is licensed for SC use only. 5
Adverse reactions in patients receiving Nucala 100mg SC (n=263) 5
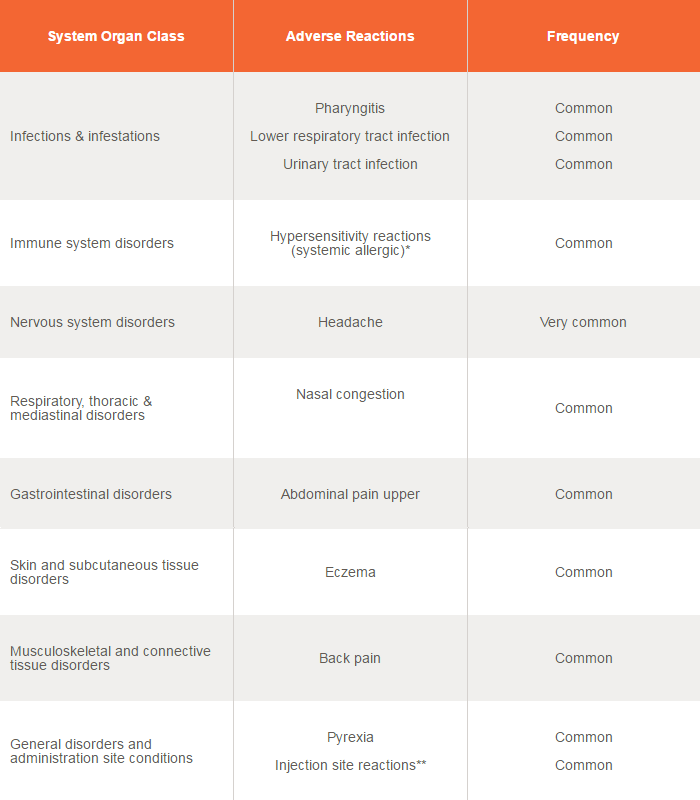
The frequency of adverse reactions is defined using the following convention: very common (≥1/10) and common (≥1/100 to <1/10).
*Systemic reactions including hypersensitivity have been reported at an incidence comparable to that of placebo. 5
**The most commonly reported adverse reactions during treatment were headache, injection site reactions and back pain. 5
In the MENSA and SIRIUS studies, the incidence of adverse events and serious adverse events with Nucala were found to be similar to placebo when both were added to high dose ICS and an additional maintenance treatment(s), 134with the exception of injection site reactions, which were more frequent with Nucala (8% [21/263] for Nucala, 3% [8/257] for placebo). 5
Incidence of adverse events and serious adverse events in the MENSA and SIRIUS studies 14
- Injection site reactions occurred mainly at the start of treatment and within the first three injections with fewer reports on subsequent injections. 5
For more information on the MENSA and SIRIUS studies.
References:
- Ortega H et al. N Engl J Med 2014; 371:1198–1207.
- Data on file. CSR-MEA115588.
- Jones PW. COPD 2005; 2:75–79.
- Bel E et al. N Engl J Med 2014; 371:1189–1197.
- Nucala SmPC
Nucala is a trademark of the GSK group of companies.
NUCALA (mepolizumab), 100 mg pulver till injektionsvätska, lösning, 100 mg injektionsvätska, lösning i förfylld spruta, 100 mg injektionsvätska, lösning i förfylld penna, 40 mg injektionsvätska, lösning i förfylld spruta. Medel vid obstruktiva luftvägssjukdomar, övriga systemiska medel för obstruktiva lungsjukdomar Rx (F), ATC kod: R03DX09
Terapeutiska indikationer: Nucala är indicerat som tilläggsbehandling vid svår refraktär eosinofil astma hos vuxna patienter, ungdomar och barn från 6 års ålder. Nucala är avsett som tilläggsbehandling till intranasala kortikosteroider för behandling av vuxna patienter med svår CRSwNP, som inte uppnår tillräcklig sjukdomskontroll med systemiska kortikosteroider och/eller kirurgi. Nucala är avsett som tilläggsbehandling till patienter från 6 års ålder med remitterande eller refraktär eosinofil granulomatös polyangit (EGPA). Nucala är avsett som tilläggsbehandling för vuxna patienter med otillräckligt kontrollerat hypereosinofilt syndrom (HES) utan identifierbar icke-hematologisk sekundär orsak.
Ytterligare information: I kliniska studier visades effekt hos följande subpopulation: aktuell standardbehandling som minst inkluderade högdosbehandling med inhalerade kortikosteroider (ICS) plus ytterligare en underhållsbehandling, två eller fler exacerbationer under de senaste 12 månaderna eller beroende av systemiska kortikosteroider samt blodeosinofilvärde minst 150 celler/μl vid behandlingsstart eller minst 300 celler/μl under de senaste 12 månaderna
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne
Varningar och försiktighet: För att underlätta spårbarheten av biologiska läkemedel ska den administrerade produktens namn och batchnummer tydligt anges i patientjournalen. Mepolizumab ska inte användas för att behandla akuta astmaexacerbationer. Astmarelaterade biverkningar eller exacerbationer kan förekomma under behandling. Abrupt utsättning av kortikosteroider efter behandlingsstart med mepolizumab rekommenderas ej. Akuta och fördröjda systemiska reaktioner, inklusive överkänslighetsreaktioner (t.ex. anafylaxi, urtikaria, angioödem, hudutslag, bronkospasm, hypotoni), har förekommit efter administrering av mepolizumab. Patienter med befintliga maskinfektioner ska behandlas innan behandling med mepolizumab påbörjas. Om patienten blir infekterad under behandling med Nucala och inte svarar på maskmedel ska temporär utsättning av Nucala övervägas. Nucala har inte studerats hos patienter med organ- eller livshotande symtom av HES eller EGPA.
Graviditet: Som en försiktighetsåtgärd bör man undvika användningen av Nucala under graviditet. Administrering av Nucala till gravida kvinnor ska endast övervägas om den förväntade fördelen för modern är större än den eventuella risken för fostret.
Subventionsbegränsning: Subventioneras endast för patienter med svår eosinofil astma som är otillräckligt kontrollerade trots standardbehandling och antingen behandling med perorala kortikosteroider (OCS) i doser som ger ökad risk för biverkningar eller när OCS är kontraindicerat.
För fullständig förskrivningsinformation och pris, se www.fass.se.
Datum för översyn av produktresumén: 2022-10-11
GlaxoSmithKline AB, Box 516, 169 29 Solna. Tel 08-638 93 00, www.se.gsk.com.
För printmaterial lägg till nedanstående text
Om du vill rapportera en biverkning på något av våra läkemedel eller vacciner så kan du kontakta oss på följande sätt: Webformulär: se.gsk.com/biverkning. Telefon: 08-638 93 00 (be om att bli kopplad till Biverkningsenheten)
För digitalt material lägg till nedanstående text
Om du vill rapportera en biverkning på något av våra läkemedel eller vacciner så kan du kontakta oss på följande sätt: Rapportera en biverkning via webbformulär eller via telefon på 08-638 93 00 (be om att bli kopplad till Biverkningsenheten)






